Статья, из которой взят рисунок 5 домена 23S рРНК в плохом автопереводе на русский:
Стрелками позиционированы мутации, которые приводят к резистентности к антибиотикам. В общем это не важно.
Выпуск 216
Лаборатория Наномир
Когда реальность открывает тайны,
уходят в тень и
меркнут чудеса ...
Научная дискуссия Виктория Соколик - Александр Кушелев
(для специалистов)
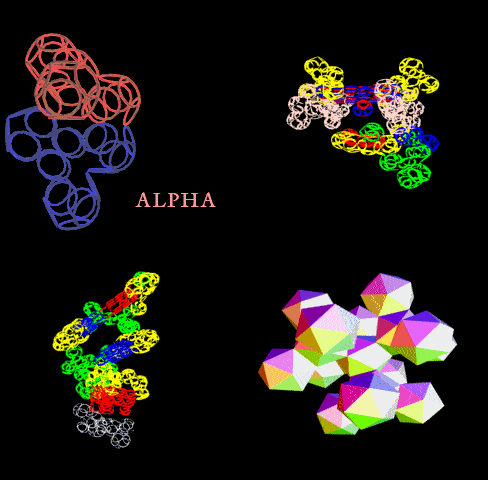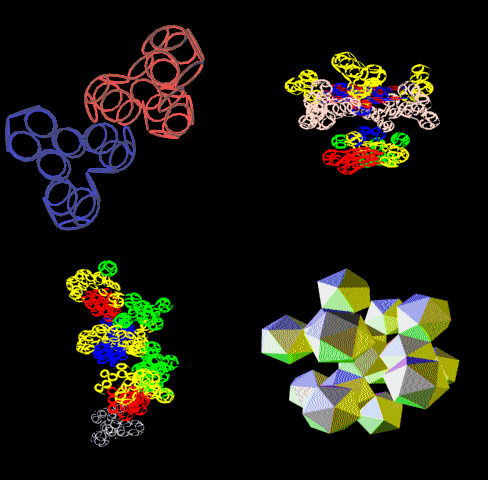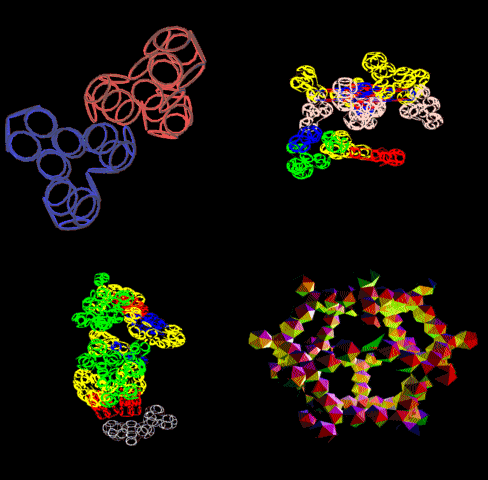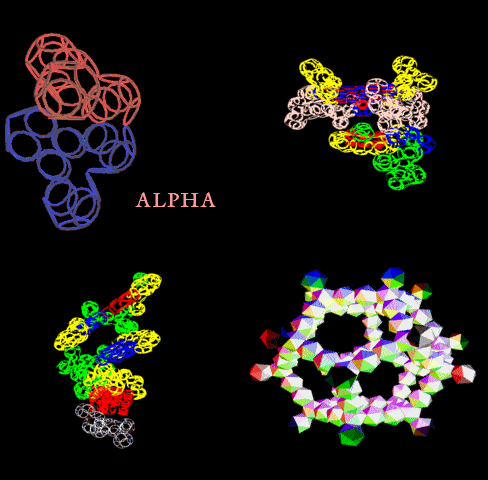
Пятый домен рибосомальной РНК
Кушелев: Это и есть одна из двух лопастей про-рибосомы, которая связывается с тРНК?
Виктория Соколик: Это пятый домен 23S рРНК, о котором Вы спрашивали.
Кушелев: Огромное спасибо!
А в статье было написано, что центр связывания состоит из двух лопастей, одна из которых содержит 110 нуклеотидов. Всё сходится?
Схема очень интересная, только непонятно, что означают всякие стрелочки, значки?
По ссылке очень мало пояснительного текста. Может быть есть статьи, желательно на русском языке, где об этом подробно
написано?
Особенно интересен материал о взаимном расположении минорных оснований тРНК и элементов про-рибосомы...
Интересно, с чего это вдруг появилась РНК, которая стала соединять друг с другом аминокислоты? И не просто ведь. Она же с тРНК работала, т.е. тРНК появились раньше? Они куда-то таскали аминокислоты, а рРНК заставила их собирать из аминокислот белки...
Вообще надо бы разобраться с добелковым миром. Ведь там уже кипела РНК/ДНК-жизнь...
Белковый мир - это по существу инструментальная среда для РНК/ДНК, которые, собственно и создали эту среду для себя...
Это большое кольцо чем-то напоминает плазмиду, кольцевую ДНК,
только плазмида - двойная спираль, а эта одинарная, но со "шпильками",
как и положено для ДНК ![]()
В статье было написано, что вторая лопасть образовалась в результате репликации первой.
Интересно понять, как запрограммировалась эта лопасть...
Скорее всего началось всё с некой РНК, замкнувшейся в кольцо. Это кольцо могло выполнять функцию про-плазмиды. Потом у неё появились шпильки. В конце-концов один из мутантов кольца со шпильками оказался способным управлять транспортными РНК, заставляя их собирать полипептиды из аминокислот. До этого тРНК таскали аминокислоты, вероятно, на самосборку.
Виктория Соколик:
Статья, из которой взят рисунок 5 домена 23S рРНК в плохом автопереводе на русский:
Стрелками позиционированы мутации, которые приводят к резистентности к антибиотикам. В общем это не важно.
Oleg Ustinov: что это?
Кушелев: Это - схема А-минорных связей в рибосоме. Связи направленные. Красные кружочки означают, что при разрыве связи с этой стороны разрушения структуры РНК не происходит. Отсюда следует, что в процессе эволюции первым появился 5-ый домен
Эта схема нужна для создания пикотехнологической модели рибосомы, которая будет в ~1000 раз точнее той, за которую в 2009-ом году дали Нобелевскую.
Пикотехнологические модели кристаллинов, гистонов и шаперонов уже созданы. Их можно посмотреть в 212-ом выпуске рассылки "Новости лаборатории Наномир": http://nanoworld88.narod.ru/data/212.htm
Уважаемая Виктория!
А
Вы можете рассказать о нестандартных нуклеотидах, представленных на
этой схеме? Я подозреваю, что именно в них "собака зарыта" ![]()
На первый взгляд вообще не видно минорных оснований. Но нестандартные участки явно просматриваются...
Виктория Соколик: Минорных оснований на схеме не видно не только на первый взгляд, но и на десятый. Я не в курсе есть ли они в этой части 23S рРНК. Тут два варианта: либо их нет, либо авторы не потрудились их специально выделить на схеме. Одно могу подсказать: в комплементарных парах модифицированных оснований быть не может. Таким образом можно предполагать их только в петлях.
Кушелев: Не существует комлементарных минорных оснований? Любопытно...
А если в прото-рибосоме нет минорных оснований, значит она в процессе эволюции появилась раньше тРНК...
Я подозреваю, что в процессе эволюции параллельно появились несколько кольцевых и несколько разомкнутых РНК. На некоторых кольцевых РНК, а позднее ДНК появились шпильки, которые задавали начало репликации. Одна из кольцевых РНК и превратилась в процессе эволюции в прото-рибосому.
Интересно было бы проследить, какие РНК эволюционировали параллельно, тогда будет проще разобраться с из взаимодействием...
Модели азотистых оснований Виктории Соколик
Виктория Соколик: Если быть точными, то некоторые минорные нуклеотиды "спариваются", только такие пары не могут присутствовать в составе нуклеиновой спирали, они нарушают её упорядоченность.
Я напомню: комплементарные пары обычных нуклеотидов:
Правильнее в данном контексте говорить о модифицированных, а не минорных нуклеотидах, поскольку, например, тимин не является минорным в ДНК, но очень редко встречается в РНК.
Кушелев: Понятно. А что это за участки на схеме 5-го домена, где в разрыве цепи с одной стороны стоят символы GC CA UU ?
Виктория Соколик: Вы могли бы догадаться, что это подобие минипетли или шпильки из двух нуклеотидов
Кушелев:
А... Понял. Благодарю! Догадаться трудно, т.к. между ними чёрточек не
проставлено, как между другими. А раз обозначение нестандартное, лучше
уточнить у знатоков ![]()
И что значат жирные точки вместо чёрточек-связей? Некомплементарные пары G*U, U*U, ?
Виктория Соколик: Затрудняюсь ответить определённо. Быть может речь идёт о предполагаемом взаимодействии G с U и U с U без формирования канонической комплементарной пары.
Кушелев: Понятно. Значит Ваши модели неканонических пар ещё можно дополнить ![]()
А как с А-минорными взаимодействием? Смоделируем?
Виктория Соколик: Охотно ![]() .
.
Кушелев: Сразу начинать моделирование в 3D Studio, как показывает мой опыт, пустая трата времени. Начинать надо с пластмассовых моделей.
Кстати, в моей модели АСС-конца есть необычная связь
аденина с рибозой цитозина. Интересно, как она соотносится с А-минорным
взаимодействием? Там декларируется 4 водородных связи, а в моей модели
АСС-конца их просматривается 1, если не менять структуру азотистого
основания, но если его тоже модифицировать, то вполне может получиться 4
![]() Я могу
попробовать смоделировать модифицированный аденин, где может получиться 4
водородных связи с рибозой цитозина...
Я могу
попробовать смоделировать модифицированный аденин, где может получиться 4
водородных связи с рибозой цитозина...
... предлагаю Вам по-настоящему смоделировать тРНК. А для этого придётся докопаться до информации о соседстве минорных оснований тРНК и ответных элементов рРНК.
Интересно понять механизм поворота тРНК в рибосоме.
Виктория Соколик: рРНК для поворота аминокислотного остатка НЕ НУЖНА. Аминокислотные остатки в рибосому приходят на хвосте уже готового собственного поворотного адаптора в виде изоакцепторной тРНК.
Кушелев: Обождите, как это в рибосому приходят, если она не нужна? Тут надо определиться, либо приходят в рибосому, либо она не нужна. Одно другое исключает...
Виктория Соколик: Рибосома нужна, но не для управления углами поворота.
В тРНК как раз жёстко детерминирован этот угол поворота и он НЕ МЕНЯЕТСЯ в рибосоме. Если же нужно присоединить аминокислотный остаток под другим углом, то её на своём хвосте приносит другая изоакцепторная тРНК, в которой также неизменно детерминирован этот самый другой угол поворота не изменяющийся ни до, ни в, ни после взаимодействия с рибосомой. Разновидностей таких адапторов -- изоакцепторных тРНК -- по три для большинства аминокислот (для некоторых 1 или 2).
Кушелев: Э... Маловато будет. Либо тРНК должно быть 61 штука, либо угол поворота аминокислоты меняется внутри рибосомы.
Вы хотите сказать, что для 6 аргининов существует 6 тРНК? Для 4 аланинов существует 4 тРНК? Для 61 триплетного кода существуют 61 тРНК?
Виктория Соколик: ДА.
Кушелев: В таком случае действительно поворотов тРНК не требуется. Но мне хотелось бы убедиться, что существует 61 разновидность тРНК.
Вариабельная петля задаёт лишь начальный угол. А конечный зависит от триплета ![]()
Виктория Соколик: Рибосома нужна только как вместилище двух центров, для удержания рядом двух тРНК с аминокислотами на хвостах одновременно в одном месте: чтобы пептидная связь смогла образоваться между соседними аминокислотами. Потом предыдущая тРНК отщепляется и уходит из рибосомы, а тРНК с синтезирующимся полипептидом на хвосте перемещается на её место. И приходит новая ацилированная тРНК и всё повторяется вновь. Обслуживание такого перемещения также входит в функции рибосомы.
Кушелев: Вариабельная петля задаёт лишь начальный угол. А конечный зависит от триплета.
Виктория Соколик: НЕТ. Угол задаёт местоположение нуклеотидов дигидроуридиловой и псевдоуридиловой петель, которые формируют между собой комплементарную пару в данном варианте изоакцепторной тРНК, в двух других вариантах изотРНК комплементарная пара образуется между нуклеотидами в других позициях этих петель. Триплет угол ни физически, ни геометрически не определяет, он служит всего лишь маркером соответствия для перекодирования информации иРНК в белок.
***
Виктория Соколик: атомы различных элементов таблицы
Менделеева имеют на внешней орбите от 1 до 8 электронов (в среднем 4 ![]() ). Таким образом, разрешение кольцегранных моделей молекул в 4 раза (а не в 1000 раз
). Таким образом, разрешение кольцегранных моделей молекул в 4 раза (а не в 1000 раз ![]() ) БОЛЬШЕ шарико-стержневых. Но и этого вполне достаточно, чтобы найти много нового и предсказать неизвестного.
) БОЛЬШЕ шарико-стержневых. Но и этого вполне достаточно, чтобы найти много нового и предсказать неизвестного.
Кушелев: Точность пикотехнологической модели определяется не диаметром электрона, а длиной волны Комптона, т.е. по существу малым радиусом тора, который на два порядка меньше большого радиуса тора. Короче, пикотехнологическая точность - это доли пикометра. В идеале точность пикотехнологических моделей вообще не ограничена
В случае пикотехнологических моделей надо напомнить, что в них нет места
принципу неопределённости, поэтому они могут в принципе дать любую
точность. Например, учёт зависимости радиуса электрона от условий
(напряжённости электрического, магнитного, гравитационного,
гуковского... полей) повысит точность пикотехнологических моделей. Но
даже модели из колец одинакового радиуса (у молекул белка диаметры
электронов внешней оболочки одинаковы с точностью до долей процента)
дают точность на два-три порядка выше, чем точность моделей "шар-труба" ![]()
При
этом углы между направлениями на атомные ядра определяются в модельных
пикотехнологических экспериментах, а для построения шаро-стрежневых
моделей нужны экспериментальные данные...
Пикомеханика ДНК / РНК

Атомы в пикотехнологической модели показаны уже не шариками, а кольцегранниками, где точность связана не с радиусом шарика, а с толщиной кольца, а эта толщина - не доли нанометра, а доли пикометра, т.е. в ~1000 раз меньше.
В
нанотехнологической модели электроны "размазаны", а в
пикотехнологической модели координаты их центров известны с любой
наперёд заданной точностью. Почувствуйте разницу между неопределённостью
К"М" и бесконечной точностью классической механики ![]()
Виктория Соколик: Всего 55 различных тРНК необходимо для перекодирования 61 кодона в 21 аминокислоту.
Кушелев: А почему 55, а не 61?
Виктория Соколик:
Потому что не четыре варианта композиционного кода, а ТРИ варианта ротамерной конфигурации пептидной связи детерминировано 61 кодоном для 21 аминокислоты.
Потому что кодоны с С в третьем положении, также как и с G в третьем положении, детерминируют один вариант ротамерной конфигурации пептидной связи.
Кушелев: Понятно. Значит 55 - это Ваше гипотетическое число. Экспериментально нашли пока 45 разных тРНК.
Давайте посчитаем, сколько разных тРНК требуется, согласно моей системе гипотез.
Для аминокислот с 4 кодами нужно 2 тРНК
Для аминокислот с 3 кодами нужно 2 тРНК
Для аминокислот с 1 кодом нужна 1 тРНК
А теперь считаем:
Lys - 1
Asn - 1
Thr - 2
Arg teta - 1
Ser teta - 1
Ile - 2
Met - 1
Gln - 1
His
- 1
Pro - 2
Arg lambda - 2
Leu lambda - 2
Glu - 1
Asp - 1
Ala - 2
Gly - 2
Val - 2
Tyr - 1
Ser lambda - 2
Cys - 1
Trp - 1
Leu teta - 1
Phe - 1
Итого 32. Это минимальное количество тРНК. В реальности может потребоваться больше, т.к. пары углов могут отличаться меньше или больше, чем поворот тРНК при замене первого нуклеотида антикодона. Если зазор между первым нуклеотидом антикодона и инозином меняет угол на 120 градусов, то одной тРНК можно обойтись для вариантов 1 и 3. Для вариантов 2 и 4 это уже не подходит. Поэтому аминокислоты с 3 и 4 вариантами композиции должны иметь не по 2, а по 3 тРНК. Пересчитаем количество тРНК в этом случае:
9*3=27
14*1=14
27+14=41
Это уже очень похоже на экспериментально обнаруженной число тРНК (45).
Если же каждому коду будет соответствовать одна тРНК, то их должно быть 61.
61-45=16. Это означает, что число тРНК на 16 меньше, чем число композиций. Если бы они не вертелись, то их было бы на 16 штук больше, т.е. на ~треть.
Если же учесть, что управление всеми аминокислотами должно быть единообразным, то для каждой аминокислоты должно быть 2 разных тРНК. 23 аминокислоты - 46 тРНК. Исключение может составлять метионин, для которого может существовать только одна тРНК. В этом случае число тРНК будет ровно 45.
***
Виктория Соколик: В кишечной палочке E. coli выявили уже 45 видов тРНК, кодируемых различными генами.
Кушелев: Это - совсем другое дело. 45 - это не 61.
Виктория Соколик: Это значит, что несколько различных тРНК могут соединяться с одной и той же аминокислотой. Разные изоакцепторные тРНК могут узнавать разные кодоны для данной аминокислоты.
А по Вашей таблице композиционного кода и концепции "всё-таки тРНК вертятся" разновидностей тРНК должно быть 21, в крайнем случае 24 с учётом ротамерных вариантов аргинина, серина и изолейцина.
Кушелев: Вовсе нет. тРНК должно быть не меньше 24, но вполне может быть и 61. В этом случае тРНК уже могут не вертеться ![]()
Есть ли экспериментальные данные по поводу существования 4 и более тРНК для одной аминокислоты? Дело в том, что Ser, Leu и Arg - это пары изомеров. Один из них кодируется двумя разными триплетами, а другой - четырьмя. Чтобы закодировать все аминокислоты нужно 61 триплет и столько же тРНК, если они не вертятся. Из эксперимента известно, что для одной аминокислоты может быть 2 тРНК, третья относится к другому изомеру. Так что "всё-таки тРНК вертятся" (С) А.Кушелев.
Виктория Соколик: Ваша гипотеза не отвечает на вопрос зачем клетке такое количество разных тРНК
Кушелев: Отвечает. Инозин позволяет поворачивать тРНК на два разных угла в зависимости от первого нуклеотида антикодона. Если для этой аминокислоты существует более двух вариантов композиции, то требуется более одной тРНК.
Виктория Соколик: Почему именно с инозином?
Кушелев:
Первым нуклеотидом антикодона часто является инозин. Зазор между ним и
третьим нуклеотидом кодона как раз и определяет композиционный угол ![]()
Виктория Соколик: И какой смысл тогда в Вашем композиционном коде, если антикодоны GYX и AYX, которые комплементарны кодонам XYC и XYU, определяют то ли альфа-спираль, то ли Пи-спираль, как карта ляжет в рибосоме.
Альфа-/Пи-
переключается тРНК с одной вариабельной петлёй, а для бета- и 310-
нужны две тРНК с разными вариабельными петлями. Точные ответы на эти
вопросы мы, конечно же сможем узнать
только из эксперимента. Тогда и выяснится, какая из моделей была ближе к
истине ![]()
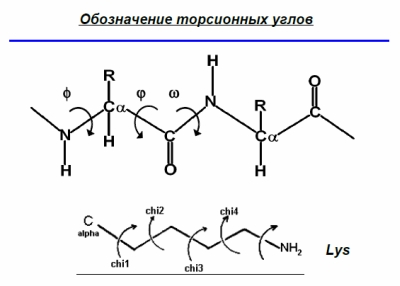
diprospan: а торсионные углы с С[а]-хиральными центрами как то надо брать во внимание или это не существенно ?
Кушелев: Эти
углы взяты из неправильной модели, поэтому надо просто поменять модель,
после чего вместо двух углов останется один. Он и задаётся таблицей
композиционного генетического кода ![]()
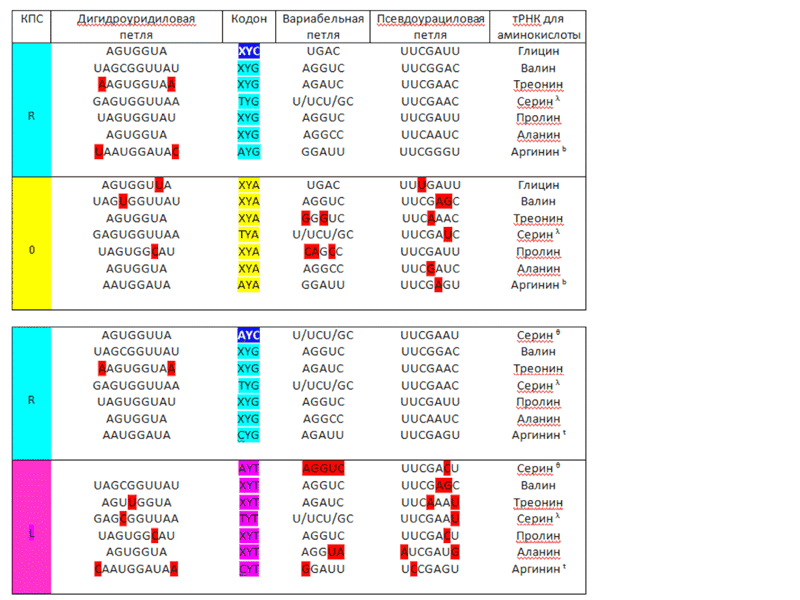
Здесь показаны три варианта, как у Виктории Соколик, но один из них расщепляется ещё на три, два из которых кодируются, а третий (одиночный вариант 1/4) получается автоматически из любого из них.
Кушелев: Зазор между ним и третьим нуклеотидом кодона как раз и определяет композиционный угол.
Виктория Соколик: Зазора там никакого быть не может или приведите схему с указанием специфики водородных связей именно для взаимодействия инозина с др. нуклеотидом. Геометрия инозина на это не указывает.
Кушелев: Инозин, как написано в учебнике молекулярной биологии, может стыковаться с разными нуклеотидами. Естественно, что и длина пары будет разной. В Ваших моделей то 6, то 7 колец получается.
Виктория Соколик: Смотрим на таблицу с вариабельными петлями тРНК для некоторых аминокислот (вторая часть голубо-розовая) и не видим экспериментального подтверждения Вашему тезису, поскольку изменения в вариабельной петле наблюдаются только у 3 из 7 сравниваемых вариантов (меньше 50% это не статистика):
 Кушелев: Так изменения в вариабельной петле и не должны быть, если одна петля работает на два композиционных угла
Кушелев: Так изменения в вариабельной петле и не должны быть, если одна петля работает на два композиционных угла ![]()
Виктория Соколик: Хорошо, по Вашему не должны, а они есть, и как с этим быть. Может гипотеза не верна, а?
Кушелев: Они не должны быть, если не было бы рудиментов. А они есть ![]()
***
Кушелев: А почему Вы решили, что должны быть изменения в вариабельной петле?
Потому что Вы написали, что "для бета- и 310- нужны две тРНК с РАЗНЫМИ вариабельными петлями". А мы видим, что не только длина этих петель не изменяется, но и нуклеотидные замены выявлены только в 30% случаев.
Кушелев:
Давайте разберёмся более подробно. Вы написали, что изменения есть, но
не в 100% случаев. И нуклеотидные замены есть "в 30% случаев". Кстати,
непонятно, как Вы получили число 30%, если у Вас фигурировали цифры 2 и 7
![]()
***
Кушелев:
Инозин, как написано в учебнике молекулярной биологии, может
стыковаться с разными нуклеотидами. Естественно, что и длина пары будет
разной. В Ваших моделей то 6, то 7 колец получается.
Виктория Соколик: Разная длина пары за счёт количества колец не имеет никакого отношения ни к зазору, ни к углу поворота.
Кушелев: Разность
длин (7-6) я и назвал зазором, хотя, вероятно, неудачно ![]()
***
Симметрия псевдоуридина может оказаться ключом к разгадке псевдоуридиновой петли тРНК...
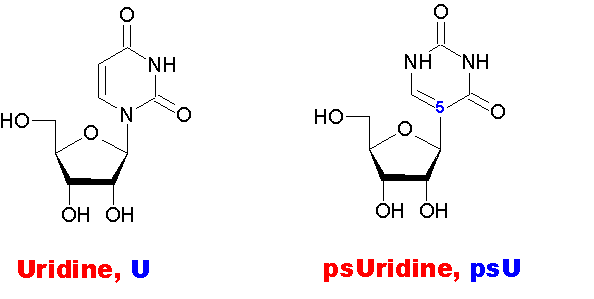
Уважаемая Виктория! Вы говорили, что у Вас есть модель уридина и псевдоуридина. Вы не могли бы показать обе эти модели?
***
Пространственная структура биомолекул
В паре A-U атомы могут быть расположены симметрично. Есть какие-либо экспериментальные данные против такого расположения атомов в азотистых основаниях ДНК/РНК?
Кушелев: Если Ваши пикотехнологические модели урацила и псевдоурацила верны, то напрашивается мысль, что в псевдоуридиновой петле тРНК комплементарный нуклеотид развёрнут на 180 градусов, поэтому и приходится заменять урацил на псевдоурацил.
Моя модель, скорее всего ошибочна, т.к.
поворот азотистого основания на 180 градусов ничего не меняет, т.е.
псевдоурацил не отличается от урацила ![]()
Уважаемая Виктория! Мне Ваши пикотехнологические модели азотистых оснований начинают нравиться больше моих ![]()
Исправляем ошибки в пикотехнологических моделях.
Кушелев: Там не азот-углерод, а кислород-углерод, но моя модель, конечно, ошибочна.
Виктория Соколик: Кто б сомневался, не прошло и года ... ![]()
Кушелев: Откуда ж я знал, что существует псевдоурацил, которые не может быть урацилом? ![]()
Моя модель ошибочна по крайней мере по расположению ядер. Геометрия электронных оболочек пока ещё под вопросом.
Интересно, с каким азотистым основанием может взаимодействовать псевдоурацил? Там противоположная петля не содержит случайно комплементарный нуклеотид для псевдоурацила?
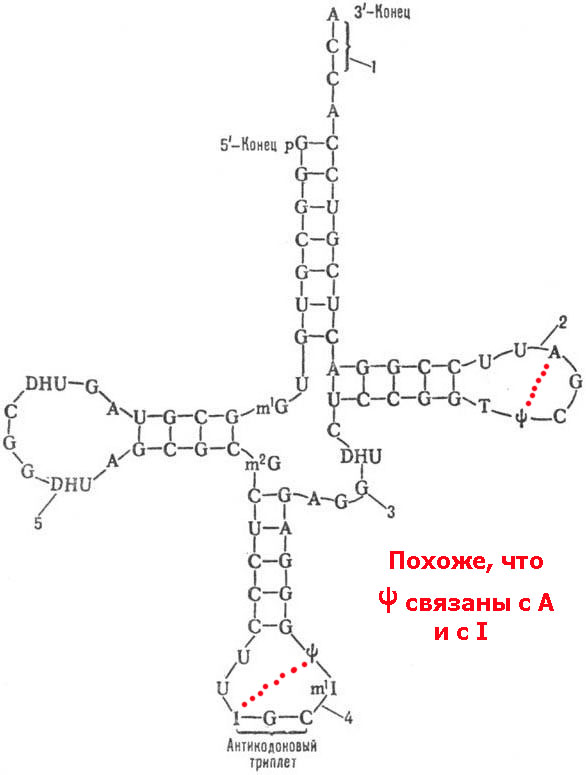
Виктория: Почему это похоже? В петлях псевдоурацилу очень трудно дотянуться до аденозина и инозина, но возможно. Только такие конструкции очень напряжёнными получаются и вряд ли могут удерживаться водородными связями.
Кушелев: А Вы видели мою модель АСС-конца тРНК? Никаких напряжений ![]()
Давайте
попробуем сделать модели, где псевдоурацил соединён с
аденином/инозином. Хотя инозин должен быть свободен, ведь это же
антикодон ![]()
Хотя там есть другой инозин. Минорный какой-то ![]()
***
Для
того, чтобы сделать пикотехнологические модели псевдоуридиновой и
антикодоновой петель нужно соединить нуклеотиды через суставы. Очень
удобно пользоваться кнопками для одежды. Нужно, чтобы нуклеозиды
поворачивались вокруг связи P-O фосфорной кислоты. К модели валентного
электрона атома фосфора прикрепляется кнопка-гнездо, а к модели
валентного электрона кислорода - кнопка-штеккер. После этого
производятся повороты вокруг связей P-O до тех пор, пока псевдоуридин не
совместится с аденином. Интересно, как при этом будут ориентированы
замыкающие петлю гуанин и цитозин? ![]()
Виктория Соколик: Кстати, там как раз показана возможность взаимодействия псевдоурацила с аденином с формированием одной водородной связи. Я не понимаю, зачем это нужно. Если Вы знаете, то делайте.
Кушелев: Нет, Вы не догоняете. Псевдоурацил будет повёрнут на 180 градусов, поэтому с аденином будут сформированы три водородных связи, а длина пары будет стандартной, т.е. как в канонических комплементарных парах.
Можно ли обойтись без рибосомы?
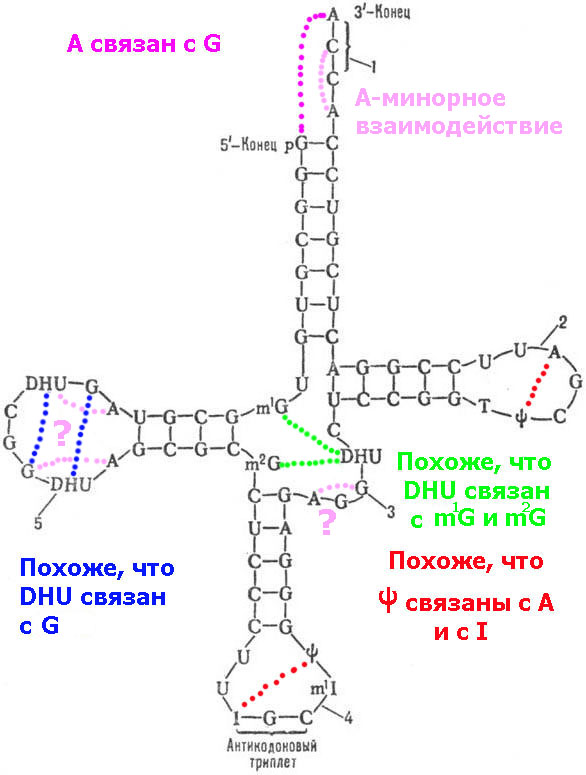
Интересно понять, что это за минорное основание DHU ?
Уважаемая Виктория! У Вас кажется была модель этого минорного основания...
Короче, нужны структурные схемы:
DHU-5,6-дигидроуридина,
m1I-1-метил-инозина,
m1G-1-метилгуанозина,
m2G-N2-диметилгуанозина
Когда рибосомы не было...
Могут ли возникать связи между соседними тРНК?
Может ли синтезироваться белок без рРНК?
Вообще-то белки могли синтезироваться и без рибосомы, и без тРНК...
тРНК могли "взять контроль" над синтезом белков. Позднее могла появиться иРНК, которая упорядочила деятельность тРНК. Ещё позднее могла появиться рРНК, которая повысила надёжность процесса управления сборки белков.
***
Виктория Соколик: Связи будет только две, см. схему:
Кушелев: Две так две. Главное, что связь будет с теми же параметрами, что и A-U.
Кушелев: Что-то я не понял, чем DHU отличается от U ?
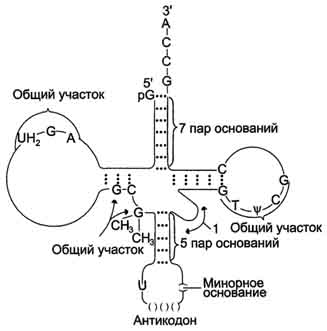
Прикольная схемка тРНК попалась. На ней красиво показано минорное основание CH3-G-CH3
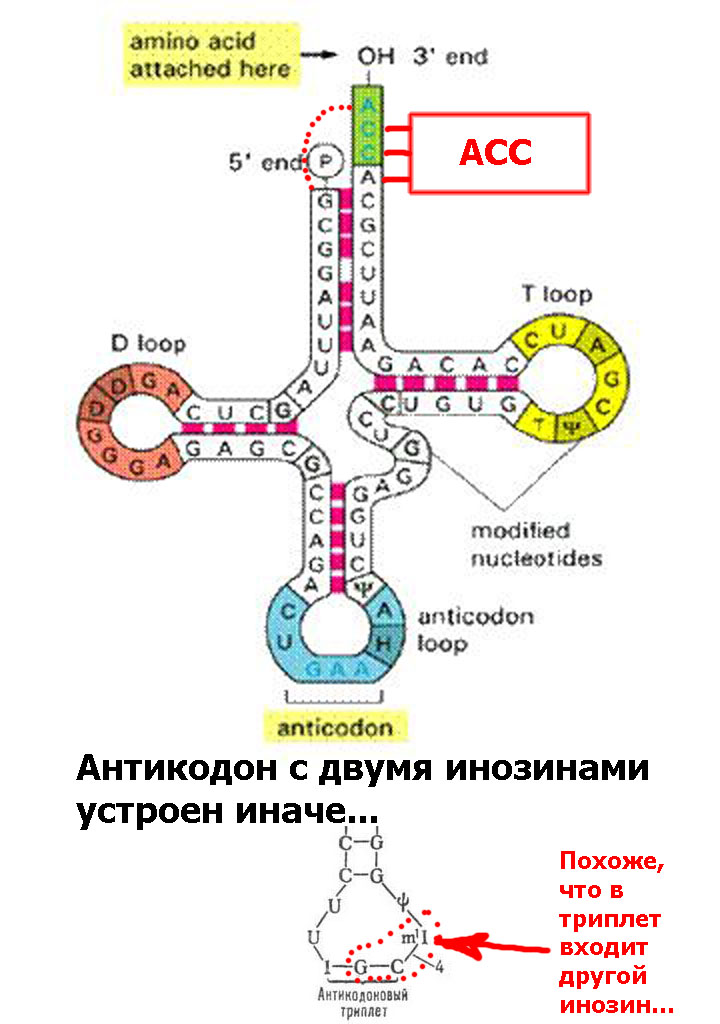
Кушелев: Я правильно понял, что есть более простые тРНК?
***
Кушелев пишет: Могут ли возникать связи между соседними тРНК?
Виктория Соколик: Могут, но не должны, иначе тРНК будут агрегировать и КПД их работы сильно уменьшится. Поэтому клеверный листок тРНК и сворачивается в L-образную конформацию. Чтобы спрятать активные центры комплементарных нуклеотидов псевдоуридиловой и дигидроуридиновой петель от взаимодействия с другими тРНК.
А те связи, которые Вы понарисовали внутри петель тРНК с участием модифицированных нуклеотидов энергетически очень не выгодны, поскольку выходит стерически очень напряжённая структура. Сделайте физические модели петель и сами это почувствуете.
Кушелев:
Выгодны / не выгодны - зависит от модели. Если атомы изображаются
шариками, то органические молекулы из них вообще не должны образоваться.
![]()
А кольцегранные модели минорных оснований и тРНК разных уровней эволюции я планирую изготовить. Правда, для этого мне нужно закупиться кнопками для одежды, чтобы сделать суставы для поворота вокруг связей P-O. Денег на кнопки пока не хватает, поэтому придётся подождать спонсорской поддержки...
***
Виктория Соколик: Дигидроурацил будет также плохо взаимодействовать с диметилгуанином, как и сам гуанин (см. картинку для дигидроурацила)
Кушелев:
Пока что я не понял, чем отличается DHU от U. На схемах, которые я
нашёл в инете даже псевдоурацил от урацила не отличается...
***
Кушелев: А Вы допускаете, что процесс взаимодействия тРНК может происходить с помощью катализатора, который существенно проще рибосомы и даже её активного цента, т.е. 5-ого домена?
***
Кушелев: Что-то я совсем запутался. Раньше Вы писали, что DHU отличается от урацила отсутствием двух протонов, а на этих картинках даже структурные схемы отличаются.
Хотелось бы увидеть для сравнения две схемы из учебника.
***
Виктория Соколик: Для синтеза белка тРНК взаимодействуют с мРНК и полимеризация тРНК здесь вообще противопоказана.
Кушелев:
Ну так и не надо поли... Подошла вторая тРНК, присоединилась к первой с
помощью простого катализатора, белок достроился, катализатор ушёл,
первая тРНК ушла, подошла третья тРНК ![]()
Я
подозреваю, что синтез белка с помощью иРНК и тРНК возможен и без
рибосомы. И даже без 5-го домена рРНК. Что-то более простое могло
выполнять функцию рибосомы. Как Вы считаете? А рибосома понадобилась для
экономии числа тРНК. Ведь если тРНК вращать, их количество можно
сократить, причём раза в полтора, если не больше. При этом надёжность
трансляции тоже увеличивается. А это значит, что растёт и качество и
скорость, а общая масса тРНК уменьшается раза в полтора. Эволюция однако
![]()
***
Кушелев: А какие у них структурные схемы? У урацила я знаю, а у DHU ?
Кушелев: Попробую...
***
Кушелев: Ну так и не надо поли... Подошла вторая тРНК, присоединилась к первой с помощью простого катализатора, белок достроился, катализатор ушёл, первая тРНК ушла, подошла третья тРНК.
Victoria: Это, к сожалению, беспочвенная фантазия. Чтобы образовалась пептидная связь между двумя аминокислотами, они должны быть рядом, а у Вас даже на картинках хвосты тРНК за километр друг от друга.
Кушелев: Это же схема. В реальности там другие углы и расстояния. ![]()
Кушелев: Ну так если тРНК будет 61 штука, то их можно не крутить. Все углы можно задать вариабельными петлями. А рибосома, которая может поворачивать тРНК позволяет сократить их число в ~полтора раза.
Кушелев: Но полимеризация аминокислот может происходить вообще без тРНК ![]()
Кушелев: В том случае, если комплементарные пары открыты для взаимодействия. Если же они повёрнуты, как скрученный кончик листа, то требуется распрямление, что и может делать катализатор/фермент
Кушелев: Очень интересно. А как же кодируются 86 разных тРНК, если кодов всего 61 ?
***
Виктория: Я уже все петли тРНК доделала
Кушелев: А мы сравним потом Ваши модели с моими. Я убеждён, что все петли чем-то похожи на АСС-конец, т.е нет в них просветов, как на Ваших моделях и на схемах из учебников.
***
Здесь можно увидеть, как мы познакомились с Викторией Соколик: http://nanoworld88.narod.ru/forum/18/092.htm
